山东大学齐鲁医院张澄教授/张运院士团队在 ScienceAdvances 杂志上发表了研究论文 “NPRC deletion attenuates cardiac fibrosis in diabetic mice by activating PKA/PKG and inhibiting TGF-β1/Smad pathways”, 研究了 NPRC 在糖尿病心肌病(DCM)心脏纤维化进展中所起的作用。研究人员发现在 DCM 的人和小鼠中 NPRC 表达都增加,而 NPRC 的缺失可减轻心脏纤维化并改善心脏的重塑和功能。因此,通过心脏特异性的基因或药物治疗来抑制 NPRC 为治疗糖尿病相关的心脏纤维化提供了一个非常有潜力的靶点。
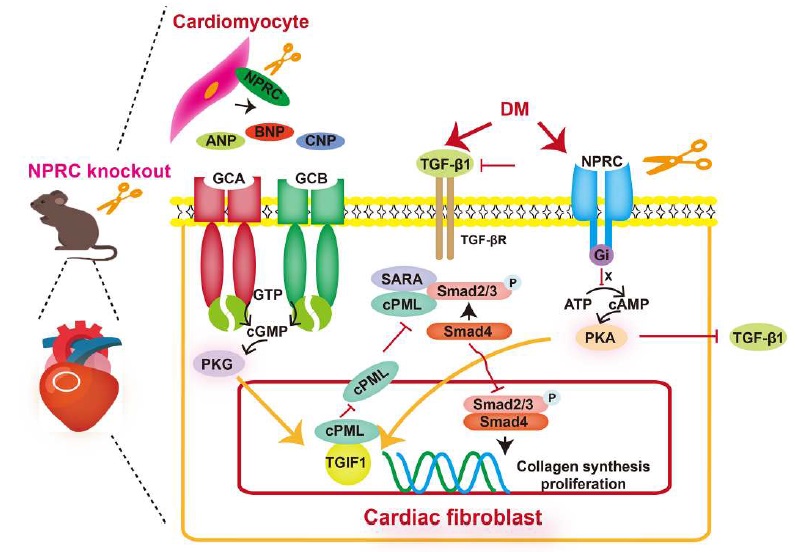
心脏纤维化在糖尿病心肌病(DCM)的进展中起着关键作用。前期的研究证明了利钠肽的心脏保护作用,然而,钠尿肽受体 C (NPRC)对扩张型心肌病心脏纤维化的影响尚不清楚。在这里,研究人员观察到在患 DCM 的小鼠和患者的心肌中 NPRC 的表达都增加。NPRC−/− 糖尿病小鼠表现出心脏纤维化的减轻,心脏功能和重塑的改善。在心脏成纤维细胞和心肌细胞中敲降 NPRC 基因都可降低胶原合成和心脏成纤维细胞的增殖。通过 RNA 测序分析表明 NPRC 的敲除提高了 TGIF1 的表达,而 TGIF1 可抑制 Smad2/3 的磷酸化。此外 TGIF1 的上调是由 NPRC 敲除诱导的 cAMP/PKA 和 cGMP/PKG 信号的激活所介导的。这些发现表明 NPRC 的缺失减轻了糖尿病小鼠的心脏纤维化,改善了心脏的重塑和功能,为治疗糖尿病性心脏纤维化提供了一个非常有前景的方法。
1、在糖尿病小鼠和糖尿病及 HF 患者的心脏中 NPRC 的表达增加
为了阐明 NPRC 在 DCM 进展中的作用,研究人员通过连续注射链脲佐菌素(STZ),然后喂食 16 周来构建 DCM 小鼠模型。免疫荧光染色和蛋白免疫印迹显示,与对照组小鼠相比,糖尿病小鼠心脏中的 NPRC 表达增加(图 1)。相反,在 DM 组和对照组的心脏之间,未检测到 GCA 和 GCB 表达的显著差异。通过蛋白免疫印迹技术分析来自健康和患有糖尿病和严重 HF 但没有高血压和冠状动脉狭窄的患者的心脏 NPRC 的表达。结果显示,与健康人相比,糖尿病和 HF 患者的 NPRC 表达显著增加(图 1)。
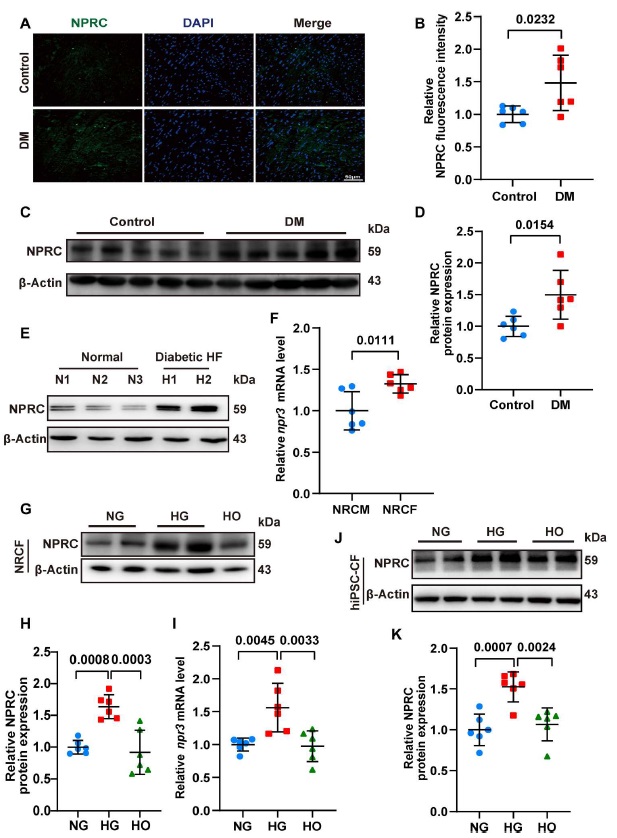
图1
由于心脏由大约 30% 的心肌细胞(CM)和 70% 的非 CM 组成(主要是心脏成纤维细胞 CF)。因此,研究人员比较了 NPRC 在新生大鼠的原代 CM(NRCM) 和 CF(NRCF) 中的表达。聚合酶链式反应(PCR)分析显示 NRCF 中 npr3 的 mRNA 水平高于 NRCM(图 1)。通过免疫荧光染色测定了三种 NPR 在 NRCF 中的分布。结果表明,在相同的曝光条件下 NPRC 的强度远高于 GCA 或 GCB 的强度。这些结果表明,在培养的 NRCF 中 NPRC 占了大部分 NPR 这与以前的报道是一致的。然后,用不同浓度的葡萄糖处理原代的 NRCF 细胞。与正常葡萄糖组(NG; 5.5mM)相比,通过 WB 和 PCR 分析检测发现,高糖组(HG; 33.3mM) NRCF 中 NPRC 的 mRNA 和蛋白表达显著增加,而高渗组(HO)和 NG 组之间的 NPRC 表达没有观察到显著差异,因此排除了渗透压升高对 NPRC 表达的影响。此外,从人的诱导多能干细胞(hiPSC CF)分化得到的人 CF 也用 NG, HG 和 HO 来进行处理。使用 WB 来检测,结果显示在 hiPSC CF 中,与 NG 和 HO 组相比 HG 组的 NPRC 增加(图 1)。这些结果表明 NPRC 可能参与 CF 的功能和 DCM 的进展。此外,研究人员用 NG, HG 和 HO 处理 NRCM 也发现 HG 处理的 NRCM 中的 NPRC 表达也高于 NG 或 HO 处理组,这表明 CM 中的 NPRC 也可能参与了 DCM 的进展。
2、NPRC 缺失改善了糖尿病小鼠的心功能和重塑
为了研究 NPRC 在 DCM 进展中的作用,研究人员构建了 NPRC-/- 小鼠。通过对野生型(WT)和 NPRC-/- 小鼠的心脏组织进行 WB 分析证实了 NPRC 的缺失。在接下来的 16 周里,糖尿病组小鼠的血糖水平和体重与对照组有显著差异。然而 WT 和 NPRC-/- 小鼠的体重和血糖水平均未显示出显著差异(WT + control versus NPRC−/− + control; WT + DM versus NPRC−/− + DM)。敲除小鼠 NPRC-/- 的收缩压(SBP)低于 WT 小鼠,而舒张压(DBP)和心率没有观察到显著差异(WT + control versus NPRC−/− + control; WT + DM versus NPRC−/− + DM)。四组小鼠的血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)水平没有显著差异。
为了探讨 NPRC 缺失对心脏功能和重塑的影响,在对小鼠行安乐死前进行了超声心动检测。与’WT+对照组’的小鼠相比,’WT+DM 组’的小鼠出现了心脏收缩和舒张功能障碍,表现为左心室射血分数(LVEF)、左心室短轴缩短率(LVFS)以及舒张早期与舒张晚期二尖瓣血流速度之比(E/A)的降低和‘舒张早期二尖瓣血流与二尖瓣环速度比值(E/E’)’的增加。而 NPRC 缺失改善了由’NPRC−/−+DM 组’糖尿病所诱导的心功能异常,与’WT+DM 组’相比,小鼠的 LVEF, LVFS, E/A and E/E’ 都得到了恢复。此外,在’WT+DM 组’中,由糖尿病所诱导的左心室舒张末期直径(LVEDD)和左心室收缩末期直径(LVESD)的增大在’NPRC−/−+DM 组’中也因 NPRC 的缺失而得以恢复,这表明心脏的重塑功能有所改善(图 2)。
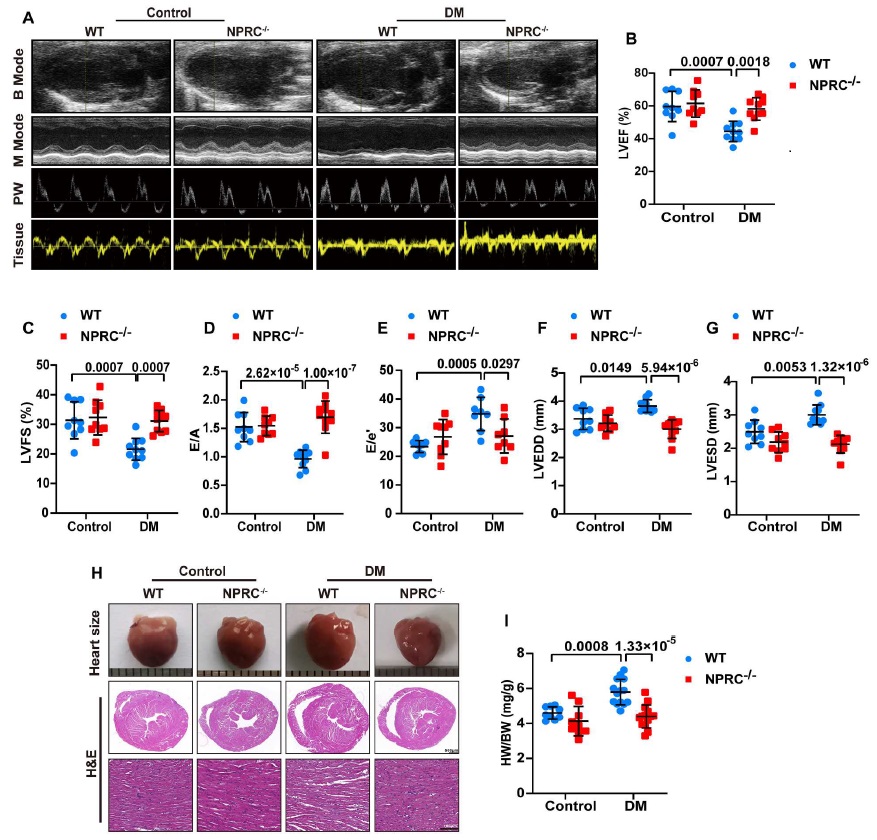
图 2
一般来说,’WT+DM 组’的 WT 小鼠的心脏大小比’WT+对照组’的大,在 NPRC−/−+DM 组中的 NPRC 缺失减弱了这个表型。心脏重量与体重的比值(HW/BW)也证明了这种特征。形态学分析显示,在 H&E 染色下,’WT+DM 组’的 WT 小鼠表现出显著的心肌紊乱,而’NPRC−/−+DM 组’则减弱了这种紊乱(图 2)。
3、NPRC 缺失在体内可减轻糖尿病诱导的心脏纤维化
由于心脏纤维化是 DCM 的一个显著特征,因此,研究人员在体内实验中(WT+对照、NPRC−/−+对照、WT+DM 和 NPRC−/−+DM)中检测了心肌纤维化的程度。使用 Masson 染色显示,在’WT+对照组’和’NPRC−/−+对照组’的小鼠中很少表现出心肌纤维化。与’NPRC−/−+DM’小鼠相比,糖尿病增加了’WT+DM’小鼠心脏血管周围和间质空间的胶原积聚。通过免疫组化(IHC)分析 I 型胶原和 III 型胶原,结果显示’WT+DM 组’的胶原表达高于’NPRC−/−+DM 组’。蛋白免疫印迹(WB)在四组小鼠中也显示出了相似的胶原表达变化(图 3)。这些发现表明 NPRC 缺失在体内减轻了糖尿病心脏的心脏纤维化。研究人员还检测了四组小鼠左心房的纤维化程度。使用 Masson 染色和针对 I 型胶原和 III 型胶原的 IHC 来进行分析,结果显示’WT+对照组’和’NPRC−/−+对照组’的小鼠显示出相似程度的左心房纤维化,而’NPRC−/−+DM 组’的小鼠相对于’WT+DM 组’显示出左心房胶原积聚的减少,这与左心室的变化相似。
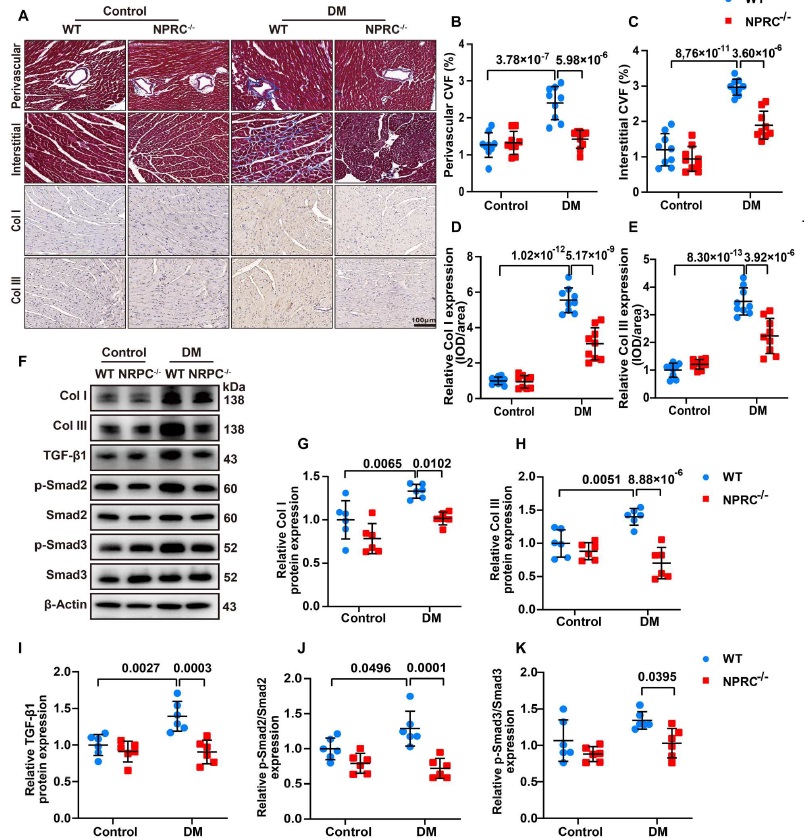
图3
TGF-β1 是一种与纤维化进展有关的关键促纤维化细胞因子,并且它与经典 Smad 信号通路相关。因此,研究人员使用 WB 检测了 TGF-β1/Smad 信号通路中相关介质的表达水平。结果显示,与’WT+DM 组’相比,’NPRC−/−+DM 组’中 TGF-β1, p-Smad2 和 p-Smad3 的表达水平都降低,表明 NPRC 缺失抑制了 TGF-β1/Smad 信号通路的激活(图 3)。
由于 NPRC 通过其细胞内结构域参与 cAMP/PKA 信号通路的抑制和循环 NPs 的清除,研究人员认为 NPRC 缺失可能影响了细胞内 cAMP/PKA 信号通路和细胞外 NPs 的清除。为了验证这一假设,研究人员分两部分进行了体外实验。在第一部分中,通过将 si-NPRC 转染到 NRCF 和 hiPSC CF 中来降低 NPRC 蛋白表达,然后用 NG(5.5mM)或 HG(33.3mM)处理细胞 72 小时。在第二部分中,考虑到 NPs 不仅由 CF 表达和分泌,而且由 CM 表达和分泌。在 HG 刺激下,在 CM 中 NPRC 的表达增加,研究人员首先通过在 NRCM 和 hiPSC CM 中转染 si-NPRC 来降低 NPRC 的蛋白表达,然后 NG 或 HG 刺激 48 小时。随后,用 NRCM 上清液处理 NRCF 而用 hiPSC CM 上清液处理 hiPSC CF 72 小时。
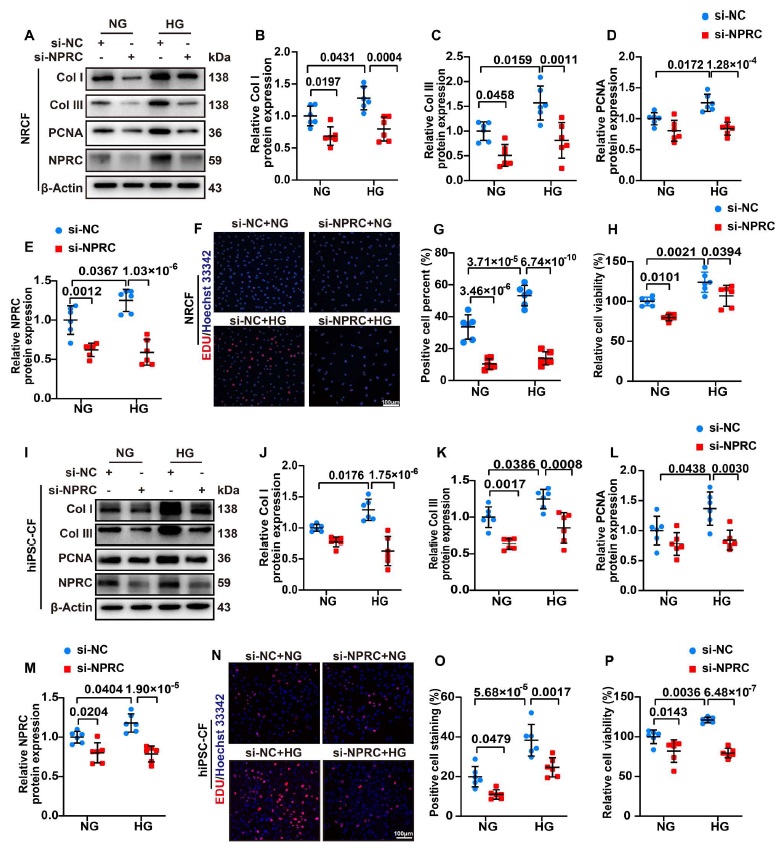
图4
如前所述 TGF-β1/Smad 信号通路在 CF 胶原合成和增殖的调节中起着至关重要的作用。因此,研究人员评估了 NRCF 的 TGF-β1/Smad 信号通路的变化。实验 WB 的结果显示,在 si-NC+HG 组中 HG 处理增加了 TGF-β1 的蛋白表达以及 Smad2 and Smad3 的磷酸化(p-Smad2 and p-Smad3),而在 si-NPRC+HG 组中 NPRC 敲低则逆转了这一现象。相反 TGF-βR2 的蛋白表达没有表现出显著变化。这些结果表明 NRCF 中 NPRC 的敲低降低了 TGF-β1 的表达和 Smad2/3 的磷酸化,导致胶原合成和增殖受到抑制。通过 WB 在 hiPSC CF 中观察到了类似的结果。
在第二部分中,与 si-NC+HG 组相比,在 si-NPRC+HG 组中用 NRCM 上清液处理 NRCF 显著降低了 I 型胶原和 III 型胶原的蛋白质表达。在用 hiPSC CM 上清液处理的 hiPSC CF 中观察到了类似的结果。使用 EDU 和 CCK-8 测定还表明,与 si-NC+HG 组相比,用来自 si-NPRC+HG 组的 NRCM 和 hiPSC CM 上清液处理可显著抑制 NRCF 和 hiPSC CF 的增殖。通过 WB 测定显示 PCNA 的蛋白表达显示出类似的变化(图 5)。蛋白免疫印迹还检测了 TGF-β1/Smad 信号通路的变化,表明用 NPRC 缺失的 NRCM 上清液来处理,因子 TGF-β1 的表达没有改变。然而,在用来自 si-NPRC+HG 组的 NRCM 上清液处理的 NRCF 中 p-Smad2 and p-Smad3 的表达仍然低于用来自 si-NC+HG 组上清液处理的组。通过蛋白质印迹在用 hiPSC CM 上清液处理的 hiPSC CF 中观察到了类似的结果。这些结果表明,调节 TGF-β1/Smad 信号通路的机制在 NPRC 缺失的 CF 中和在用 NPRC 缺失 CM 上清液处理的 CF 中是可能不同的。
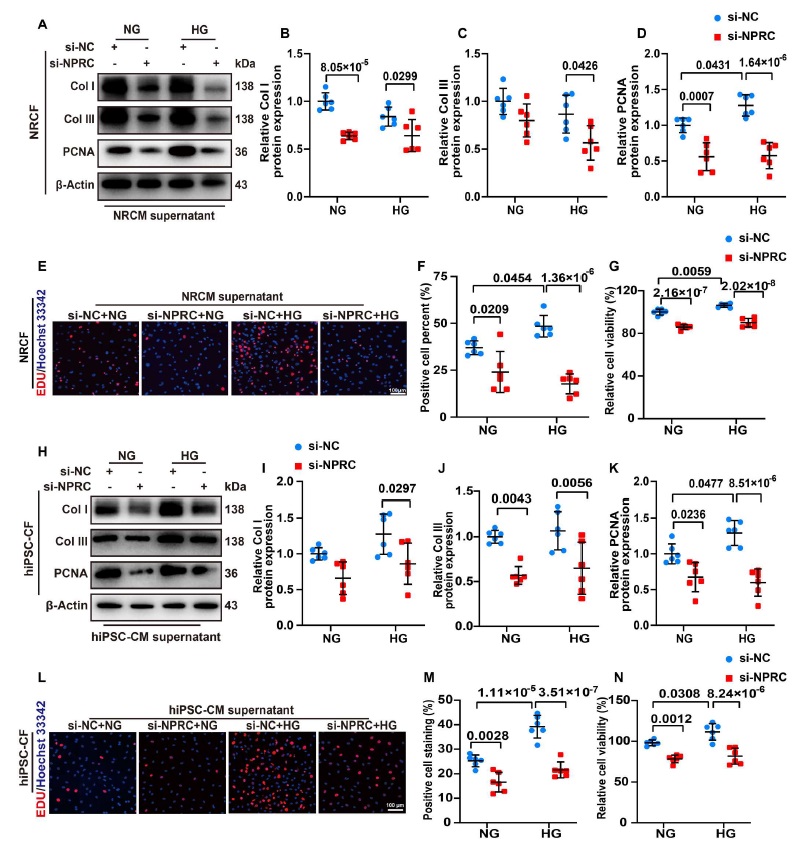
图5
5、NPRC
缺失抑制了心脏成纤维细胞(CF)的胶原合成和增殖
为了进一步探索 NPRC 对胶原合成和增殖作用的调节机制,研究人员使用 NRCF 进行了转录组 RNA 测序。基因表达谱在各组内的样品中具有高度可重复性。基因本体论(GO)富集显示,在 NRCF 的 si-NC+NG 和 si-NC+HG 组之间表现出显著差异的前 10 个生物过程中,主要涉及的是染色体分离和细胞周期的过程。这一发现与上述结果一致,即与 si-NC+NG 组相比 si-NC+HG 组 NRCF 的增殖增加。此外,研究人员发现,将 si-NC+HG 和 si-NPRC+HG 组进行比较,对有机物的反应、信号转导的调节和细胞增殖是被影响最大的生物过程。然后,研究人员选择了在这些过程中最频繁重复的 24 个上调和 16 个下调基因来进行研究。在这些基因中,研究人员重点研究了与纤维化相关的 7 个上调和 2 个下调基因,通过分析它们在 NRCF 中的表达水平和倍数变化,研究人员最终选择 Tgif1 来进行进一步的研究。
Tgif1 负责编码 TGIF1 蛋白,该蛋白通过多种机制来发挥 TGF-β 信号传导的核共抑制因子的作用,包括募集转录抑制复合物来抑制 TGF-β 的转录,促进 Smad2 的泛素依赖性蛋白酶体的降解,以及将 cPML 隔离在细胞核中以防止其穿梭到细胞质从而在细胞质中促进 Smad2/3 的磷酸化。研究人员发现,在体外实验的第一部分,在 NG 和 HG 处理中 NPRC 敲低增加了 NRCF 中 tgif1 的 mRNA 水平(图 6, si-NC + NG versus si-NPRC + NG, and si-NC + HG versus si-NPRC + HG, all P < 0.001)。同样 NPRC 敲低增加了 tgif1 在 NRCF 和 hiPSC CF 中的蛋白表达(图 6)。在体外实验的第二部分中,用来自 si-NPRC+NG 或 si-NPRC+HG 组的 NRCM 和 hiPSC CM 上清液处理增加了 NRCF 和 hiPSC CF 中 TGIF1 的蛋白表达(图 6)。相对于’WT+对照’和’WT+DM 组’,在’NPRC−/−+对照’和’NPRC−/−+DM’组的小鼠中 TGIF1 蛋白的表达也分别增加(图 6)。
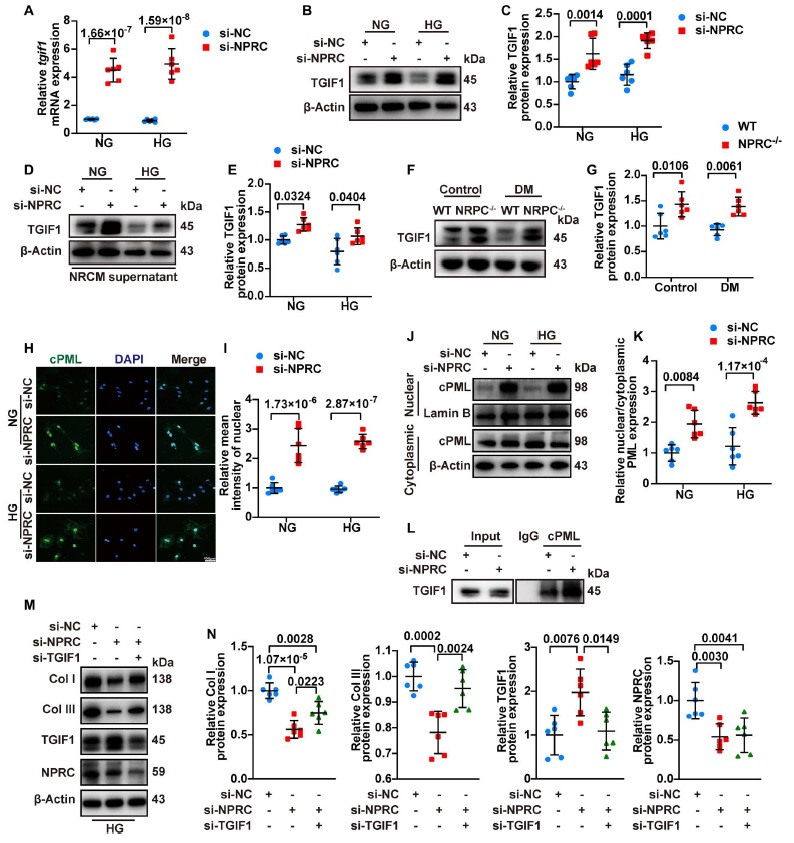
图6
为了进一步研究表达增加的 TGIF1 在 CF 中抑制 TGF-β1/Smad 信号通路的机制,研究人员用 siRNA (si-TGIF1) 转染 NRCF 以降低 TGIF1 在 NRCF 中的表达。蛋白免疫印迹显示 TGIF1 敲降后 I 型胶原和 III 型胶原的蛋白质表达显著增加。蛋白 Smad2 and Smad3 的表达没有显著变化,但 TGIF1 敲降后 p-Smad2 和 p-Smad3 水平显著增加。这些结果表明 TGIF1 通过减弱 Smad2 和 Smad3 磷酸化而不是降解 Smad2 和 Smad3 本身来抑制 NRCF 中的 TGF-β1/Smad 信号传导。
已有研究表明 cPML 是一种在细胞核和细胞质之间穿梭以促进 Smad2/3 磷酸化的关键蛋白。为了探讨 NRCF 中 NPRC 的敲除是否与 cPML 定位的变化有关,研究人员进行了免疫荧光染色,结果表明,与 si-NC+NG 和 si-NC+HG 组相比 si-NPRC + NG 和 si-NPRC + HG 分别显著增强了 cPML 的核定位。此外,研究人员分离了细胞核和细胞质蛋白,发现 si-NPRC+NG 和 si-NPRC+HG 组的细胞核和细胞质 cPML 表达水平的比率(nuclear/cytoplasmic)分别显著高于 si-NC+NG 和 si-NC+HG 组。此外,免疫共沉淀分析显示 NRCF 中 NPRC 的敲低导致了 cPML 与 TGIF1 的结合增加(图 6)。
为了进一步研究 TGIF1 是否介导了 NPRC 对胶原合成的影响,研究人员通过转染 siRNA 来同时敲降 NPRC 和 TGIF1 如体外实验的第三部分所述。与用 si-NC 转染的 NRCF 相比 si-NPRC 转染降低了 I 型胶原和 III 型胶原的蛋白表达,并增加了 TGIF1 的蛋白表达。然而,当升高的 TGIF1 水平被 si-TGIF1 敲低时,在 si-NPRC+si-TGIF 组中 I 型胶原和 III 型胶原的蛋白质表达部分被逆转(图 6)。在 hiPSC CF 中观察到了类似的结果。这些结果表明 TGIF1 在 CF 细胞中的 NPRC 缺乏调节 TGF-β1/Smad 信号传导以及胶原合成和增殖的机制中起着至关重要的作用。
上述结果证实 NPRC 通过 TGIF1 参与 TGF-β1/Smad 信号传导的调节,但 NPRC 缺失增加 TGIF1 表达的机制仍有待阐明。如前所述 NPRC 不仅作为 ANP, BNP 和 CNP 的清除受体,而且其在细胞内的部分具有 Gi 的结合结构域,可以抑制 AC 活性并降低细胞内 cAMP 的水平。为了探索 NPRC 缺失对 cAMP 水平的影响,研究人员首先在体外实验的第一部分中检测了 NRCF 的细胞内 cAMP 水平,并发现 si-NPRC + HG 组的细胞内 cAMP 水平显著高于 si-NC+HG 组。此外,研究人员通过测量 PKA 底物(RRXS*/T*)和 cAMP 反应元件结合蛋白(CREB)的磷酸化水平来研究细胞内 PKA 活性。与 cAMP 水平的变化一致,与 si-NC+NG 和 si-NC+HG 组相比 si-NPRC + NG and si-NPRC + HG 组的 p-PKA 底物和 p-CREB 的蛋白表达分别增加。研究人员还检测了 p-PKA 底物和 p-CREB 在 hiPSC CF 中的表达,并发现与 si-NC 转染组相比 si-NPRC 转染组的 p-PKA 底物和 p-CREB 水平增加。特别的,通过 WB and IHC检测发现,相对于’WT+对照组’和’WT+DM 组’,’NPRC−/−+对照’和’NPRC−/−+DM 组’的小鼠分别表现出 p-PKA 底物和 p-CREB 的蛋白表达增加(图 7)。
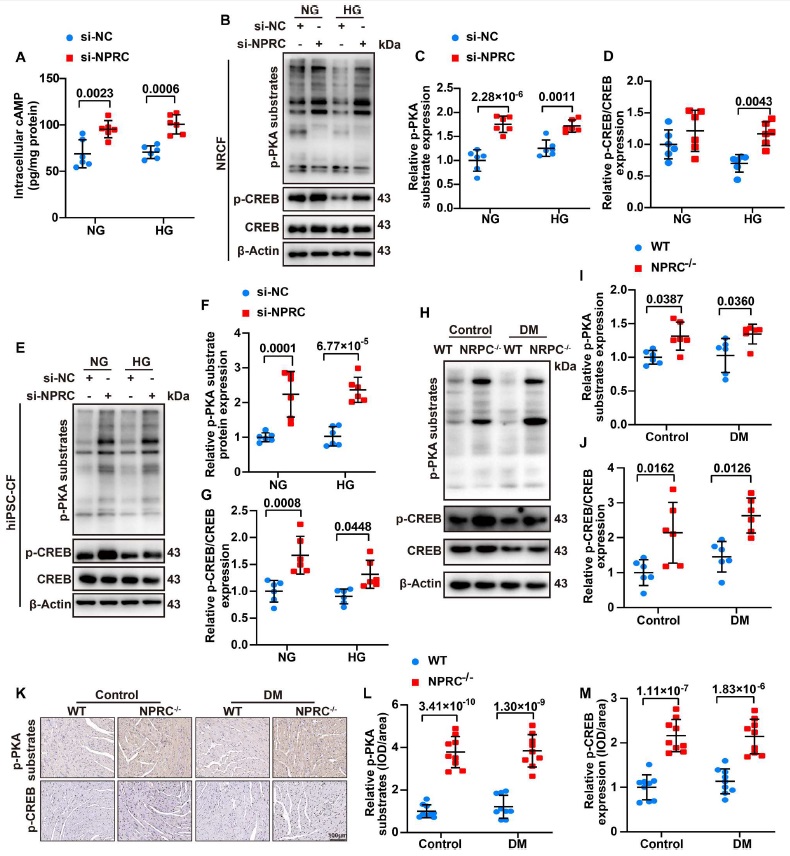
图7
IHC and WB 显示,与’WT+对照’和’WT+DM 组’相比,’NPRC−/−+对照’和’NPRC−/−+DM 组’中 VASP 的磷酸化水平分别增加,这是 cGMP/PKG 激活的指标,表明 cGMP/PKG 信号通路在 NPRC KO 小鼠中被激活(图 8)。
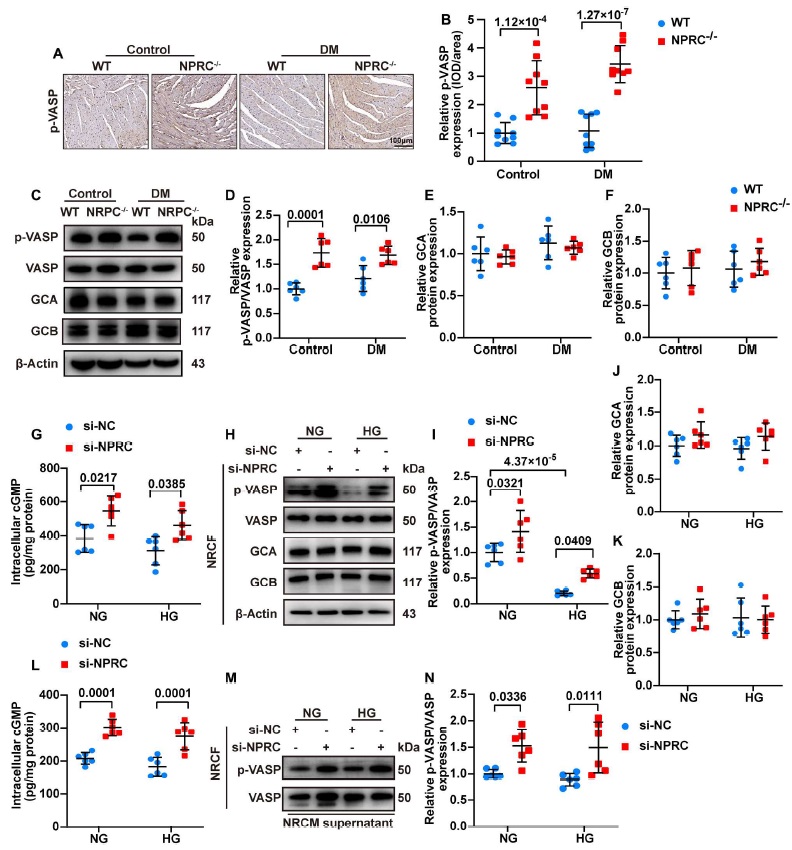
图8
由于 NPRC 负责体内 ANP, BNP 和 CNP 的清除,研究人员认为 NPRC KO 小鼠中激活的 cGMP/PKG 信号可能是由于 NPRC 降解 NPs 的能力减弱所引起的。为了验证这一假设,研究人员通过 IHC 测量了患有或不患 DM 的 WT 和 NPRC KO 小鼠心脏中 ANP, BNP 和 CNP 的蛋白表达水平。结果显示,与’WT+对照组’和’WT+DM 组’相比,’NPRC−/−+对照组’的小鼠和’NPRC−/−+DM 组’的小鼠心脏组织中 ANP, BNP 和 CNP 水平分别升高。此外,与’WT+对照组’和’WT+DM 组’相比,’NPRC−/−+对照’和’NPRC−/−+DM 组’的 ANP 和 CNP 血清水平分别升高。另一方面,尽管 WT+DM 组的 BNP 血清水平高于 WT+对照组,但 NPRC 缺失并未显著影响 BNP 的血清水平,这可能是由于血清 BNP 水平相当的低,在 WT+对照组中敲除 NPRC 并不显著增加。相反,由于心脏功能障碍 WT+DM 组的血清 BNP 水平显著升高,这可能掩盖了该组小鼠 NPRC 缺失的影响。正如预期的那样,四组小鼠中 GCA 和 GCB 的蛋白表达水平没有显著差异(图 8)。这些结果表明,体内 NPRC 缺失导致血清 NPs 水平升高和心脏局部 NPs 表达升高,从而通过未受影响的 GCA 和 GCB 来激活细胞内 cGMP/PKG 信号的传导。
此外,研究人员在体外实验的第一部分中检测了细胞内 cGMP/PKG 的活性,并发现 si-NPRC + NG and si-NPRC + HG 组 NRCF 细胞内 cGMP 的水平分别显著高于 si-NC+NG 和 si-NC+HG 组。同样的,与 si-NC+NG 和 si-NC+HG 组相比 si-NPRC + NG and si-NPRC + HG 组中 p-VASP 的表达分别增加。没有观察到 GCA 和 GCB 的表达有显著差异(图 8)。由于 CFs 能够分泌 NPs 研究人员检测了 NRCF 上清液中 NP 的水平,发现与 si-NC+NG 和 si-NC+HG 组相比 si-NPRC + NG and si-NPRC + HG 组中的三种 NPs 均分别增加。在 hiPSC CF 中观察到了类似的结果,即与 si-NC+NG 和 si-NC+HG 组相比 si-NPRC + NG and si-NPRC + HG 组的 p-VASP 水平分别增加。
此后,研究人员在体外实验的第二部分中检测了 NRCF 中 cGMP 和 p-VASP 的细胞内水平。用来自 si-NPRC+NG 或 si-NPRC+HG 组的 NRCM 上清液处理增加了 NRCF 中 cGMP 的细胞内水平和 p-VASP 的蛋白水平(图 8),这可能是因为 NRCM 上清液中 NP 水平的升高。在 hiPSC CF 中观察到了类似的结果,即用来自 si-NPRC 转染组的 hiPSC CM 上清液处理增加了 p-VASP 的表达。这些结果表明,由于 NPs 水平升高 cGMP/PKG 信号在 NPRC KO 小鼠中被激活。此外,在 NPRC 缺陷的 CF 中 cGMP/PKG 信号也被升高的 NPs 以自分泌方式激活。此外,在用 CM 上清液处理的 CF 中,在 CM 中 NPRC 的缺失也以旁分泌的方式激活了 CF 中 cGMP/PKG 的信号传导,表明存在有 CM-CF 串扰。来自 WT+DM 和 NPRC−/−+DM 小鼠 MCFs 的 WB 显示,在源自 NPRC 缺陷的糖尿病小鼠的 CF 中 p-PKA, p-CREB 和 p-VASP 的水平增加,这表明 NPRC 缺失激活了糖尿病条件下 CF 中 cAMP/PKA 和 cGMP/PKG 的信号传导。
为了比较 ANP, BNP 和 CNP 输注与 NPRC 敲除对糖尿病心脏纤维化的保护作用,研究人员进行了体内实验,在该实验中,糖尿病 WT 小鼠接受 ANP, BN 或 CNP 输注,并将 ANP, BNP 和 CNP 的作用与糖尿病 NPRC−/− 小鼠的作用进行了比较。酶联免疫吸附试验(ELISA)显示,与 DM+生理盐水组相比 DM+ANP, DM+BNP 和 DM+CNP 输注组的血清 ANP, BNP 和 CNP 水平分别显著升高,证明了 NPs 输注的疗效。相比之下 DM+NPRC−/− 组的 ANP, BNP 和 CNP 的血清水平也比 DM+生理盐水组升高,与 DM+ANP, DM+BNP 或 DM+CNP 输注组相似。尽管 ANP, BNP 和 CNP 输注以及 NPRC 缺失均降低了心肌的胶原积聚,但 NPRC−/− 小鼠在四个治疗组中表现出最为显著的改善。结果表明 NPRC 缺失表现出比外源性 NPs 输注更有效的心脏保护作用。这种有趣的效果可能是由于 NPRC 缺失同时激活了 cAMP/PKA 和 cGMP/PKG 途径,而 NPs 仅激活 cGMP/PK 途径,从而通过 NPRC 缺失可产生更好的有益效果。
由于 NPRC 缺失通过不同的机制激活 cAMP/PKA 和 cGMP/PKG 信号的传导,研究人员假设激活的 cAMP/PGA 和 cGMP/PKG 信号转导都可能上调 TGIF1 的表达。为了验证这一假设,研究人员进行了体外实验,首先用 forskolin (一种 cAMP 激动剂) 和 H89 (一种 PKA 拮抗剂)来处理 NRCF 或 hiPSC CF 细胞。结果表明 forskolin 显著激活了 PKA 信号传导,可用 p-PKA 底物和 p-CREB 水平的增加来验证,而 H89 逆转了 forskolin 诱导的 PKA 信号转导的激活。此外 forskolin 增加了 TGIF1 的蛋白表达,但降低了 p-Smad2/3 的表达。这两者都可被 H89 处理所抵消。此外 forskolin 降低了 TGF-β1 的表达水平,而 H89 也消除了这种表达水平(图 9)。这些结果表明 PKA 的激活通过抑制 TGF-β1 和增强 TGIF1 的表达来抑制 TGF-β1/Smad 信号传导。
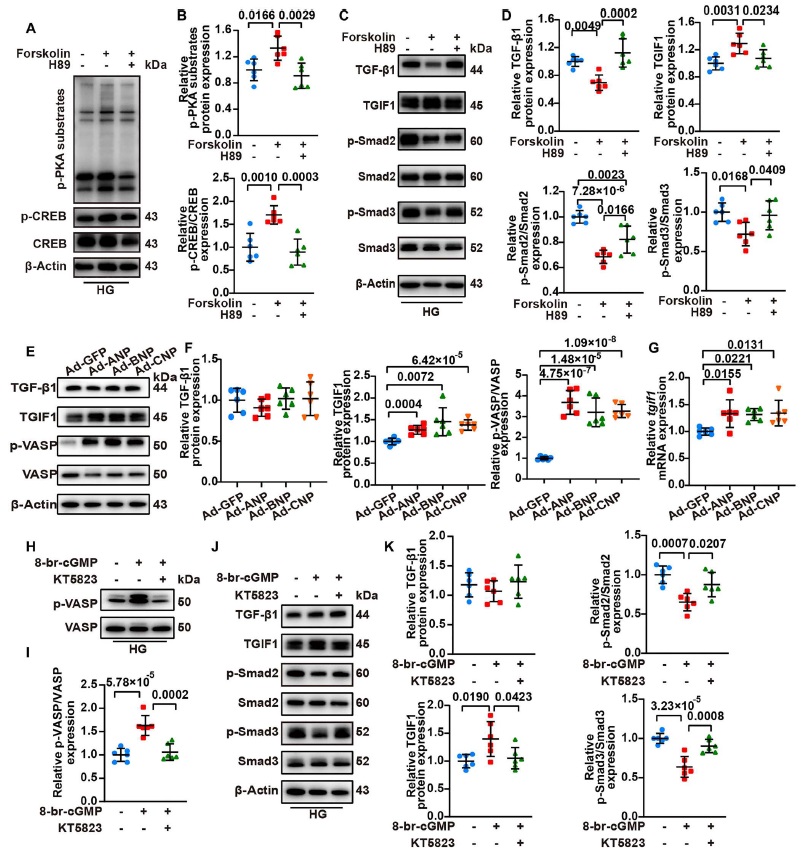
图9
本研究中所使用的 NPRC KO 条敲小鼠由PG电子提供,该小鼠是在 C57BL/6 的背景下通过 CRISPR/Cas 9 技术构建而成的。PG电子生物科技有限公司是拥有多年的基因编辑经验,已为数千名科研工作者及工业客户成功定制基因编辑模型,同时搭建了完善的基因工程动物创制平台、动物表型分析和实验技术服务平台、动物模型种源交流平台、实验动物繁育平台,欢迎您致电咨询。